PRIMER CORTE
CLASE 1
CLASE 1
ORIGEN E HISTORIA DEL LAPARAROSCOPIO
LAPAROSCOPIO
Los visores quirúrgicos están entre las formas más antiguas de instrumental médico, con algunos de los ejemplos más tempranos registrados hacia el año 70 dC. Inicialmente estaban formados por simples tubos huecos; con el tiempo estos dispositivos rudimentarios fueron adaptados para incluir lentes de aumento e iluminación, evolucionando con el paso del tiempo hasta los sofisticados visores quirúrgicos utilizados en la actualidad.
DESARROLLO DEL LAPAROSCOPIO
El primer visor iluminado, apodado el Lichtleiter, y que consistía en un tubo de observación, una vela y una serie de espejos, fue desarrollado por Philip Bozzini, en Austria en 1805. Aunque el dispositivo no encontró aceptación entre los cirujanos de la época debido a su falta de sentido práctico, sirvió como fuente de inspiración para otros inventores, y los años siguientes vieron la producción de una serie de nuevos diseños que incorporan diversos tipos de lámpara. El primer visor en ser iluminado con una fuente de luz eléctrica fue desarrollado en 1867 por Julius Bruck, un dentista de Breslau. Utilizando los principios de la iluminación incandescente, el diseño de Bruck empleaba un bucle de hilo de platino calentado con electricidad hasta que brillaba. Al igual que otras formas anteriores de visores iluminados, uno de los principales inconvenientes del diseño fue la cantidad de calor generado por la fuente de luz, que podría llevarse a cabo a lo largo de la tubería de metal del visor hasta la punta, y que presentó un riesgo significativo de quemaduras en el cirujano y el paciente.
LA FIBRA ÓPTICA Y SU RELEVANCIA EN LA LAPAROSCOPIA
No fue hasta la década de 1950, cuando la iluminación por fibra óptica se convirtió en una solución viable, y que este problema de temperatura fue resuelto. El uso de fibras ópticas como medio de transmisión significa que la fuente de iluminación pueden ser alojada bien lejos del visor mismo, lo que conduce a una reducción significativa en la cantidad del calor transmitido a la punta. El primer visor conocido de fibra óptica fue desarrollado en la década de 1930, pero no tuvo éxito debido a la mala calidad de la fibra óptica disponible en ese momento. Varios inventores contribuyeron a mejorar las capacidades de transmisión de la fibra óptica, incluyendo el holandés Abraham Van Heel, el físico británico Harold Hopkins y el americano Brian O'Brien. Inicialmente utilizado para transmitir apretados paquetes de luz, la fibra óptica se utilizó con el tiempo para transmitir imágenes, permitiendo el desarrollo de endoscopios flexibles, habiendo conseguido O'Brien una patente para un endoscopio de fibra óptica en 1954.
Otro avance significativo en el diseño de laparoscopios se produjo en la década de 1950 cuando, después de observar la necesidad de mantener una forma mejorada de endoscopio rígido durante su trabajo con la fibra óptica, Harold Hopkins presentó su innovador diseño de lentes de varilla. Anteriormente, los visores habían consistido en una serie de lentes, separados por espacios de aire, alojadas dentro de un tubo de metal. Con el fin de mantener un pequeño diámetro de visor útil, las lentes tenían que ser muy pequeñas, pero tales lentes eran extremadamente difíciles de fabricar a la vez, por lo tanto, tendían a ser de baja calidad, dando lugar a imágenes que carecían de claridad y brillo. El diseño de Hopkins hizo uso de varillas de vidrio en lugar de los espacios de aire, eliminando la necesidad de lentes por completo. La claridad y el brillo de las imágenes resultantes fue de hasta ochenta veces mayor de lo ofrecido por los dispositivos comparables en su tiempo. Además, el sistema de lentes de varilla permitía diámetros más pequeños a fabricar, permitiendo la transmisión de la luz a través de un anillo exterior, y preparando el camino para las modernas técnicas quirúrgicas mínimamente invasivas.
CLASE 2
HEMOSTASIA
Utilización del láser en cirugía laparoscópica ginecológica.
INTRODUCCIÓN Y PRINCIPIOS FÍSICOS
La palabra LASER es un acrónimo de “light amplification by stimulated emission of radiation”, que significa luz amplificada por emisión estimulada de radiación, en oposición de las fuentes habituales de luz que son espontáneas.
El haz de LASER tiene como características fundamentales las siguientes:
1.-Los fotones emitidos son coherentes en tiempo y en espacio, esto es que todos están en fase vibratoria en la misma longitud de onda para cada tipo de L A S E R .
2.-La radiación del LASER es monocromática, es decir de una sola longitud de onda, de un solo color puro.
3.-El haz de rayo LASER es unidireccional, esto es que la luz no se dispersa.
E F E C TOS BIOLÓGICOS DE LOS RAYOS L A S E R
El haz de LASER en contacto con el tejido provoca diversos efectos:
* T é r m i c o .
* F o t o q u í m i c o .
* E l e c t r o m e c á n i c o .
TIPOS DE LASER UTILIZADOS EN
GINECOLOGÍA
LASER CO 2
Es el más utilizado en endoscopia ginecológica.
Es un LASER que emite en una longitud de honda de
10600 nm, es pues la zona infrarroja lejana. Es pues
invisible requiriendo un haz de helio (rojo) que sirve
de rayo guía. Es trasmitido por el aire y se absorbe en
el agua y en los tejidos. Cuando se utiliza con una
densidad de potencia de 10 w produce una coagulación
en superficie, pero sobre los vasos tiene poco
efecto hemostático.
LASER de Neodimio
Se trata de un LASER que tiene una longitud de onda de emisión de 1.064 nm,que le da la posibilidad de ser transmitido por una fibra óptica flexible, visible y de fácil manejo. La característica fundamental de este tipo de LASER denominado solido, es que se transmite a través de líquidos ya que estos no lo absorben, esto le confiere su utilidad en cirugía hister o s c ó p i c a .
Se trata de un LASER que tiene una longitud de onda de emisión de 1.064 nm,que le da la posibilidad de ser transmitido por una fibra óptica flexible, visible y de fácil manejo. La característica fundamental de este tipo de LASER denominado solido, es que se transmite a través de líquidos ya que estos no lo absorben, esto le confiere su utilidad en cirugía hister o s c ó p i c a .
LASER KTP
se utiliza es un cristal de sal de potasio-titanio-fosfato, de una longitud de onda de 532 nm. Se sitúa esta en la zona media visible del espectro lumínico (luz verde). Su característica fundamental es que su penetrancia oscila entre los 0.3 a 2 mm en el tejido, con lo cual es bastante seguro para utilizarlo en cirugía endoscópica. Es un LASER que se trasmite bien por los fluidos y con alta capacidad coagulante.
se utiliza es un cristal de sal de potasio-titanio-fosfato, de una longitud de onda de 532 nm. Se sitúa esta en la zona media visible del espectro lumínico (luz verde). Su característica fundamental es que su penetrancia oscila entre los 0.3 a 2 mm en el tejido, con lo cual es bastante seguro para utilizarlo en cirugía endoscópica. Es un LASER que se trasmite bien por los fluidos y con alta capacidad coagulante.
LASER de Argon
Este tipo de LASER esta formado por iones de Argón que emiten en una longitud de onda entre 488- 515 nm. Es visible (azul o verde según la longitud de o n d a ) . Como característica fundamental está el hecho de que se trasmite por aire y líquidos, tiene un buen poder coagulante y hemostático sobre los vasos de pequeño y mediano calibre y los tejidos pigmentados con hemoglobina lo absorben selectivamente.
Este tipo de LASER esta formado por iones de Argón que emiten en una longitud de onda entre 488- 515 nm. Es visible (azul o verde según la longitud de o n d a ) . Como característica fundamental está el hecho de que se trasmite por aire y líquidos, tiene un buen poder coagulante y hemostático sobre los vasos de pequeño y mediano calibre y los tejidos pigmentados con hemoglobina lo absorben selectivamente.
LASER de Holmium
Se trata de un LASER solido que utiliza la sal del Holmium que emite a una longitud de onda de 2060 nm. Se transmite bien en liquido y en medio gaseoso, tiene una escasa penetración en el tejido (0,1-0,3 mm),presenta buen efecto coagulador y también capacidad de vaporización. Sin embargo su alto precio. lo hacen poco difundido en cirugía endoscópica ginec o l ó g i c a .
Se trata de un LASER solido que utiliza la sal del Holmium que emite a una longitud de onda de 2060 nm. Se transmite bien en liquido y en medio gaseoso, tiene una escasa penetración en el tejido (0,1-0,3 mm),presenta buen efecto coagulador y también capacidad de vaporización. Sin embargo su alto precio. lo hacen poco difundido en cirugía endoscópica ginec o l ó g i c a .
SALA DE CIRUGÍA
Anatomía del útero humano
Este órgano del sistema reproductivo femenino está localizado en la pelvis, anterior al recto (la parte final del intestino grueso) yposterosuperior a la vejiga urinaria . Es un órgano hueco y de paredes gruesas cuya función es la de recibir, retener y nutrir un óvulo fecundado.

1.- Cuerpo: la principal porción.
2.- Fondo: es la zona redondeada superior donde entran las trompas de Falopio.
3.- Itsmo: una porción ligeramente más estrecha ubicada entre el cuerpo y el cérvix.
4.- Cérvix: también conocido como cuello es una zona estrecha que se proyecta dentro de la vagina
La mucosa del canal cervical contiene las glándulas cervicales que segregan un moco que llena el canal, cubriendo el orifico externo. Se asume que la función de este moco es bloquear la diseminación de bacterias desde la vagina hacia el útero, pero también evita la entrada de espermatozoides durante la mayor parte del ciclo menstrual.
El útero está soportado en su sitio por varios ligamentos:
1.- Mesometrio: que es una porción del ligamento ancho.
2.- Ligamentos cervicales (cardinales) laterales: ubicados inferiormente al mesometrio y se extienden desde el cérvix y la zona superior de la vagina hasta las paredes laterales de la pelvis.
3.- Ligamentos utero-sacros: un par de ligamentos que aseguran el útero al sacro posteriormente.
4.- Ligamentos redondos: que aseguran el útero a la pared anterior del cuerpo. Estos ligamentos corren a través de los canales inguinalespara anclarse en el tejido subcutáneo de los labios externos de la vulva.

Por su parte, las gruesas paredes del útero presentan tres capas:
1.- Perimetrio: es la capa serosa más externa, es decir resulta el peritoneo visceral.
2.- Miometrio: es la capa más masiva de la pared y está compuesta por racimos de músculos lisos entrelazados. Esta capa muscular es la que se contrae rítmicamente durante el parto para expulsar el bebé al exterior del cuerpo de la madre.
3.- Endometrio: resulta el recubrimiento de mucosa de la cavidad uterina y está constituido por un epitelio simple columnar con una gruesa lámina propia de tejido conectivo muy celular. Si se produce la fecundación, el joven embrión se implanta en el endometrio y reside allí durante todo el tiempo de su desarrollo.
IRRIGACION PAREDES DEL UTERO

CLASE 4
INDICACIONES DE LA LAPAROSCOPIA GINECOLÓGICA
ESTERILIZACION TUBARICA
Durante años ha sido la única técnica realizada por esta vía, actualmente está
siendo reemplazada por la incorporación de dispositivos intratubáricos colocados
por vía histeroscópica
EMBARAZO ECTOPICO
Las técnicas posibles son:
- Salpingostomía: Indicada cuando se quiere preservar la fertilidad y la otra trompa
se encuentra dañada o ausente, siempre que las características del EE lo permitan.
Se realiza incisión monopolar de 1-2 cm en el borde antimesentérico, e inserción del
irrigador
-aspirador disecando y extrayendo el EE. Hemostasia cuidadosa de los
bordes de la incisión con energía bipolar, dejándola abierta.
- Salpinguectomía: lo más frecuente, y el tratamiento de elección si:
• EE roto.
• No existe deseo de futura fertilidad, pudiendo realizar en el mismo acto
ligadura tubárica contralateral si existe deseo de esterilización.
• Hemorragia incoercible tras salpingostomía.
• EE recidivante sobre la misma trompa.
• EE persistente.
Se realiza electrocoagulación bipolar y sección de la trompa entre el útero y el EE, y
del mesosalpinx, preservándolo en su mayor medida.
MASAS ANEXIALES
Las posibilidades terapéuticas ante una masa anexial benigna son:
- Aspirado: No recomendable como único tratamiento por el alto riesgo de recidiva, y porque el resultado citológico del líquido puede no corresponder con el resultado anatomopatológico.
- Quistectomía: Lo ideal es que se realice de forma cerrada (extirpación del quiste intacto), mediante incisión monopolar en la superficie del ovario y tracción de la capsula / contratracción de parénquima ovárico para su enucleación.
De esta manera prevenimos efectos indeseables secundarios a su ruptura: posible peritonitis química (sobre todo en endometriomas y teratomas) y diseminación de hipotéticas células malignas. En caso se ruptura, se realizará lavado profuso de la cavidad con abundante suero fisiológico. Se realizará quistectomía abierta (abrir el quiste, aspirar el contenido y extraer la cápsula posteriormente) en caso de quistes simples gigantes.
- Aspirado: No recomendable como único tratamiento por el alto riesgo de recidiva, y porque el resultado citológico del líquido puede no corresponder con el resultado anatomopatológico.
- Quistectomía: Lo ideal es que se realice de forma cerrada (extirpación del quiste intacto), mediante incisión monopolar en la superficie del ovario y tracción de la capsula / contratracción de parénquima ovárico para su enucleación.
De esta manera prevenimos efectos indeseables secundarios a su ruptura: posible peritonitis química (sobre todo en endometriomas y teratomas) y diseminación de hipotéticas células malignas. En caso se ruptura, se realizará lavado profuso de la cavidad con abundante suero fisiológico. Se realizará quistectomía abierta (abrir el quiste, aspirar el contenido y extraer la cápsula posteriormente) en caso de quistes simples gigantes.
ENDOMETRIOSIS
Endometriosis
Para la indicación quirúrgica se tendrá en cuenta: clínica, edad, deseo reproductivo
y tratamientos previos. En pacientes con deseos genésicos, debe plantearse cirugía conservadora. El tratamiento quirúrgico puede beneficiar al 60-80% de las pacientes
con dolor pélvico crónico, sin embargo en aquellas con dolor leve la indicación
quirúrgica está en debate y su beneficio puede ser mínimo12. En relación a la
fertilidad, estudios avalan mayor tasa de embarazos tras la cirugía en
endometriomas > 4cm.
MIOMECTOMIA
Para realizar la técnica quirúrgica vía laparoscópica, la mayoría de los autores
coinciden en que se han de cumplir dos condiciones:
- Tamaño del mioma principal < 8-9 cm
- Número máximo de miomas: 3-4.

HISTERECTOMIA LAPAROSCOPICA
- Endometriosis severas con poco acceso a los pedículos, grandes miomas,
importantes adherencias pélvicas.
- Pacientes con acceso vaginal limitado.
- Patología preinvasiva (hiperplasia endometrial con atipia, ca. cervical in situ).
- Patología maligna (ca. cérvix y ca. endometrio).
Actualmente, las indicaciones de la linfadenectomía laparoscópica son:
- Complemento a la cirugía radical en cáncer de cérvix y endometrio.
- Estadificación quirúrgica en casos de protocolos de QT-RT en tumores de cérvix
voluminosos o locorregionalmente avanzados, o en ca. ovario avanzado.
GANGLIO CENTINELA

CLASE 5
EMBARAZO ECTOPICO
Qué es un embarazo ectópico
Una vez fecundado en la trompa, el óvulo inicia la división celular y emprende el camino hacia la cavidad uterina, donde anidará en la mucosa preparada por las hormonas. Sin embargo, un obstáculo puede bloquear el camino del óvulo fecundado y retenerlo en la trompa. La implantación del huevo en las trompas de Falopio es el caso más común de embarazo extrauterino. En este caso, el huevo se desarrolla y anida en las paredes de la trompa, mucho más frágiles que las del útero, donde busca vasos sanguíneos para nutrirse.
La sangre se acumula en la trompa, ya dilatada por la presencia del óvulo. En esta situación, el huevo, desnutrido y sometido a la acción de las contracciones de las trompas, se desprende de las paredes y muere rápidamente. Es en este momento, cuando la trompa se rompe y provoca una hemorragia abdominal.
Causas del embarazo ectópico
- El óvulo puede tener dimensiones desproporcionadas respecto al diámetro de la trompa, no pudiendo desplazarse hasta el útero.
- El desplazamiento del óvulo puede ser lento, no llegando al útero.
- La trompa puede presentar una restricción anormal, no permitiendo el paso del huevo.
- Algunos factores pueden favorecer el bloqueo, como las consecuencias de posibles salpingitis (infección de las trompas), intervenciones quirúrgicas de las trompas, anteriores embarazos extrauterinos o malformaciones congénita.
SIGNOS
se pueden presentar desde las primeras semanas de embarazo.
- Dolores constantes en un solo lado del abdomen. Estos dolores son más o menos agudos y se producen durante el primer trimestre del embarazo. Pueden producirse aislados o acompañados de náuseas, vértigos y trastornos intestinales o urinarios.
- Los síntomas típicos de una hemorragia interna (palidez, tensión baja) también son comunes.
- Cuando la rotura de la trompa es repentina, el dolor abdominal es intenso y se produce una hemorragia en la cavidad abdominal. Además, la embarazada muestra una palidez visible, ritmo cardíaco acelerado y presión sanguínea tan baja que no se puede medir.
DIAGNOSTICO
Es fundamental un diagnóstico precoz para evitar consecuencias graves. El embarazo ectópico se puede confirmar mediante un exhaustivo exámen ginecológico, estudios de laboratorio (por ejemplo análisis de sangre) y una ecografía.
TRATAMIENTO
Los tratamientos para el embarazo extrauterino pueden ser de dos tipos: quirúrgicos o farmacológicos. Depende de la claridad del diagnóstico, del tamaño del embrión y de las técnicas disponibles. Sin embargo, a pesar de los progresos, al menos por ahora, aún no se ha conseguido recolocar el óvulo en el útero. Así que el objetivo de los tratamientos es interrumpir el embarazo extrauterino.
El tratamiento farmacológico
Interrumpe el embarazo y permite resabsorber el tejido que provoca la erosión de las paredes de la trompa. Uno de los últimos avances en este campo es una única inyección intramuscular de metotrexato. Hasta hace dos o tres años, las inyecciones eran más numerosas y las dosis más altas.
ventajas
actúa a tiempo y es indoloro. Sin embargo, cuando la medicación no es la mejor opción para tratar el embarazo ectópico, el tratamiento más adecuado es la cirugía.
actúa a tiempo y es indoloro. Sin embargo, cuando la medicación no es la mejor opción para tratar el embarazo ectópico, el tratamiento más adecuado es la cirugía.
contraindicaciones
embarazo ectópico está demasiado avanzado
dolores intensos o hemorragias internas
cuando la mamá está en el período de lactancia
cuando tiene determinadas enfermedades que hacen que la medicación no sea una buena opción.
embarazo ectópico está demasiado avanzado
dolores intensos o hemorragias internas
cuando la mamá está en el período de lactancia
cuando tiene determinadas enfermedades que hacen que la medicación no sea una buena opción.
El tratamiento quirúrgico
Si se presenta un cuadro clínico estable y el embrión es lo suficiente pequeño, puede extraerse a través de un procedimiento denominado salpingotomía. Se trata de una intervención quirúrgica que consiste en la incisión de la trompa, extrayendo el óvulo fecundado del interior, mediante laparoscopia. Se realizan tres pequeños cortes en el abdomen, que permiten reducir el tiempo de convalecencia a sólo 24 horas.
Este método conserva intacta la trompa. Sin embargo, si la trompa ha sufrido mucho daño o se tienen hemorragias intensas, puede ser necesario extirparla.
contraindicaciones
mucho tejido cicatricial en el abdomen
hemorragias intensas o el embrión es demasiado grande.
mucho tejido cicatricial en el abdomen
hemorragias intensas o el embrión es demasiado grande.
CLASE 6
TUMOR DE OVARIO
tumores de ovario de bajo potencial maligno
El tumor de ovario de bajo potencial maligno es una enfermedad por la que se forman células anormales en el tejido que cubre el ovario.
Los signos y síntomas son dolor o hinchazón del abdomen.
Las pruebas que examinan los ovarios sirven para detectar (encontrar), diagnosticar y estadificar tumores de ovario de bajo potencial maligno.
Algunos factores afectan el pronóstico (probabilidades de recuperación) y las opciones de tratamiento.
Los los tumores de ovario bajo potencial malignotienen celulas anormales que se pueden convertir en cancer, pero generalmente eso no ocurre.
Los ovarios son un par de organos del aparato reproductor femenino. Están en la pelvis, uno a cada lado del utero (el órgano hueco, en forma de pera donde crece el utero). Cada ovario tiene aproximadamente el tamaño y la forma de una almendra. Los ovarios elaboran óvulos y hormonas femeninas.
Es posible que los tumores de ovario de bajo potencial maligno no produzcan signos o síntomas tempranos. Si tiene signos o síntomas, estos pueden ser los siguientes:
Dolor o inflamación en el abdomen.
Dolor en la pelvis.
Otras afecciones pueden causar estos signos y síntomas. Consulte con su médico si estos empeoran o no desaparecen por sí solos
DIAGNOSTICO
examen fisico
examen del cuerpo para revisar el estado general de salud e identificar cualquier signo de enfermedad, como masas o cualquier otra cosa que parezca extraña. También se toman datos sobre los hábitos de salud del paciente, así como los antecedentes de enfermedades y los tratamientos aplicados en cada caso.
examen pelvico
Se introduce un espéculo en la vagina y el médico o enfermero observan la vagina y el cuello uterino en busca de signos de enfermedad. introducen uno o dos dedos de una mano cubiertos con guantes lubricadosen la vagina y colocan la otra mano sobre la parte baja del abdomen para palpar el tamaño, la forma y la posición del útero y de los ovarios. El médico o el enfermero también introducen un dedo, cubierto con un guante lubricado, en el recto para palpar si hay masas o áreas anormales.
ecografia
procedimiento en el que se hacen rebotar ondas de sonido de alta energía (ultrasónicas) en los tejidos u órganos internos para producir ecos. Los ecos forman una imagen de los tejidos corporales que se llama ecograma. La imagen se puede imprimir para observarla más tarde
ecografia tranvaginal
Se introduce en la vagina una sonda ecográfica conectada a una computadora y se mueve suavemente para mostrar los distintos órganos. La sonda hace rebotar ondas de sonido en los órganos y tejidos internos para crear ecos que componen un ecograma (imagen computarizada).
Exploración por TAC
procedimiento mediante el cual se toma una serie de imágenes detalladas del interior del cuerpo desde ángulos diferentes. Las imágenes se crean por una computadora conectada a una máquina de rayos X. Se inyecta un tinte en una vena o se ingiere, a fin de que los órganos o los tejidos se destaquen de forma más clara. Este procedimiento también se llama tomografía computada, tomografía computarizada o tomografía axial computarizada.
Ensayo de CA- 125
prueba en la que se mide la concentración de CA-125 en la sangre. El CA-125 es una sustancia que producen las células en el torrente sanguíneo. Una concentración alta de CA-125 suele ser un signo de cáncer o de otras afecciones.
biopsia
extracción de células o tejidos para que un patólogo las pueda observar almicroscopio y verificar si hay signos de cáncer. Con frecuencia, el tejido se obtiene mediante una cirugía para extirpar el tumor.
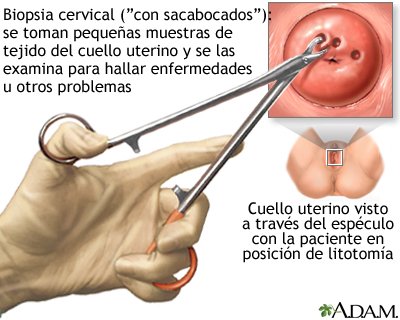
SEGUNDO CORTE
CLASE 1
DOLOR PELVICO CRÓNICO
Se entiende por dolor pélvico crónico el dolor de
localización pélvica, es decir en el abdomen bajo, que evoluciona por un
periodo superior a 6 meses.
A pesar de que, en numerosas ocasiones, se intentan atribuir
los síntomas dolorosos a causas orgánicas específicas, no es fácil clasificar
de manera simple las causas del dolor pélvico crónico.
Puede llegar a resultar muy incapacitante para la mujer y es
por eso que hay que ser minuciosos a la hora de diagnosticarlo e indicar el
tratamiento idóneo en cada caso
¿Cuáles son las causas?
Básicamente las causas pueden dividirse en dos grupos:
cíclicas y no cíclicas, lo que puede ayudar a discernir si hay un origen del
dolor relacionado con el ciclo menstrual o no.
Causas predominantemente no cíclicas:
Enfermedad pélvica inflamatoria.
Adherencias pélvicas.
Malposición uterina: neoplasias de aparato genital.
Trastorno músculo-esqueléticos.
Alteraciones gastrointestinales.
Patología urinaria.
Factores psicológicos.
Sin anomalías orgánicas demostrables.
Causas predominantemente cíclicas:
Dolor de la ovulación.
Dismenorrea primaria.
Dismenorrea secundaria: endometriosis, adenomiosis,
endometritis, estenosis cervical y leiomioma.
DIU.
Síndrome premenstrual.
¿Qué tratamientos realizamos?
Generalmente, se iniciará mediante un tratamiento
farmacológico en aquellos casos de un dolor de origen no canceroso.
En primer lugar, han de utilizarse los salicilatos. En caso
de que fracasen, la siguiente opción terapéutica son los antiinflamatorios no
esteroideos.
En tercer lugar, nos encontramos con la terapia adyuvante
con antidepresivos tricíclicos, siendo el último paso el empleo de opiáceos si
no se han obtenido buenos resultados, con todos los medicamentos anteriormente
mencionados.
En algunos casos, el tratamiento ha de ser quirúrgico
específico, según aquellas situaciones en las que se haya encontrado una
aparente o posible causa del dolor, como por ejemplo la liberación de
adherencias, la fijación uterina, la propia histerectomía.
En otras ocasiones, se realizará un tratamiento quirúrgico
de las vías del dolor con la finalidad de seccionar los nervios que transmiten
las sensaciones dolorosas
CLASE 2
ENDOMETRIOSIS
Qué es la endometriosis?
Nadie sabe con certeza por qué islotes de endometrio se
implantan fuera del útero.
Cuando este tejido crece fuera del útero, se encuentra
mayormente en la cavidad pélvica, normalmente en uno o más de estos lugares:
Sobre o bajo los ovarios
Detrás del útero
Sobre los tejidos que mantienen el útero en su lugar
Sobre los intestinos o vejiga.
En casos muy raros, las áreas con endometriosis pueden
crecer en los pulmones o en otras partes del cuerpo.
Mientras el tejido crece, puede convertirse en bultos,
llamados tumores o implantes de endometriosis. Estos tumores o implantes normalmente son benignos (no cancerosos) y
rara vez se relacionan con el cáncer.
Los implantes pueden
causar dolor leve a severo, infertilidad (no puede embarazarse), y períodos
menstruales abundantes.
Los tumores o implantes
de endometriosis son afectados por el ciclo menstrual mensual. Cada mes,
el revestimiento del útero crece preparándose para el embarazo. Si una mujer no
se embaraza, el revestimiento del útero se adelgaza y la mujer sangra.
Cuando una mujer tiene endometriosis, los implantes fuera del útero también sangran durante su
período.
Sin embargo, no hay manera de que la sangre abandone el
cuerpo, así que puede desarrollarse una inflamación y tejido cicatrizal.
También puede ocurrir obstrucción o sangrado en los
intestinos y problemas con la función de la vejiga.
Cuáles son los síntomas de la endometriosis?
Un síntoma común de la endometriosis es el dolor,
principalmente en el abdomen, en la parte baja de la espalda y en la pelvis. La
intensidad del dolor que una mujer siente no está relacionado con cuánta
endometriosis padece.
Algunas mujeres no sienten dolor aun cuando su enfermedad
afecta grandes áreas o si existe cicatrización.
Por otro lado, algunas mujeres sufren fuertes dolores aun
cuando la endometriosis les afecta partes muy pequeñas.
Los síntomas generales de la endometriosis pueden incluir
(entre otros):
Calambres menstruales extremadamente dolorosos (o
incapacitantes); con el tiempo, el dolor puede empeorar
Dolor pélvico crónico (incluye dolor en la parte baja de la
espalda y en la pelvis)
Dolor durante o después de tener relaciones sexuales
Dolor intestinal
Evacuaciones dolorosas o dolor al orinar durante los
períodos menstruales
Períodos menstruales abundantes
Manchas de sangre antes de la menstruación o sangrado entre
períodos
Infertilidad (incapacidad de embarazarse)
Además, las personas que sufren de endometriosis pueden
tener síntomas gastrointestinales parecidos a los trastornos digestivos.
Fatiga.
CLASE 3
HISTERECTOMIA LAPAROSCOPICA
La histerectomía es una de las intervenciones quirúrgicas más frecuentes en cirugía ginecológica y puede efectuarse por vía abdominal, vaginal o laparoscópica.
La vía laparoscópica es segura, eficaz y reproducible, con una baja tasa de complicaciones, superioridad estética y reducción de los tiempos de hospitalización.
La histerectomía laparoscópica técnicamente consiste en la sección laparoscópica de todas las inserciones del útero, hasta que esté liberado de todos sus puntos de fijación en la cavidad pélvica, pudiendo ser extraído posteriormente.
Sus indicaciones son: miomatosis uterina, endometriosis, adenomiosis, hemorragias uterinas disfuncionales, tumores anexiales, enfermedad inflamatoria pélvica crónica y neoplasias malignas ginecológicas.
Se expone la técnica paso a paso:
Organización preoperatoria
Debe realizarse en un quirófano, bajo anestesia general e intubación endotraqueal. Sondaje vesical permanente.
Colocación del paciente
El paciente se coloca en decúbito supino con las piernas semiflexionadas en abducción dejando el acceso vaginal fácil. Los brazos se dejan pegados al cuerpo para evitar lesiones del plexo braquial, y una cómoda disposición de los cirujanos. La posición de Trendelemburg no debe ser usada antes de la insuflación del neumoperitoneo y la introducción del primer trocar. El cirujano principal se ubica a la izquierda de la paciente. El primer ayudante con la cámara y el trocar lateral derecho. El segundo ayudante es indispensable, ya que se ocupa de la canulación y movilización uterina, y se ubica entre las piernas de la paciente.
Equipamiento técnico
Antes de comenzar la intervención es necesario verificar el material quirúrgico: laparoscopio estándar, instrumentos de coagulación-corte.
Uso de pinzas atraumáticas para la movilización de los tejidos.
Canulación del útero con manipulador uterino, aunque puede usarse simplemente un instrumento que protuya en los fondos de saco vaginales como la sonda vaginal de Apple o un simple amnioscopio. La ventaja de los manipuladores es que permiten movilizar el útero hacia todas las direcciones durante la cirugía y además incorporan un sistema que ocluye el canal vaginal y evita así la pérdida del neumoperitoneo cuando se secciona la vagina. En caso de carecer de oclusores vaginales, la puede cerrarse la vagina simplemente cerrando los labios mayores de la vulva por el segundo ayudante, si bien este procedimiento es menos eficaz que el primero.
Disposición de los trócares
La creación del neumoperitoneo y la colocación de los trocares son momentos claves de la intervención laparoscópica, ya que el 33% de las complicaciones quirúrgicas graves, sobre todo digestivas y vasculares, ocurren en ese momento de la intervención.
El primer trocar de 10 a 12 mm se coloca periumbilical (infraumbilical o supraumbilical). La introducción del trocar periumbilical puede hacerse mediante aguja de Verres o bien con técnica abierta. Nosotros preferimos la abierta. A través de este trocar se introduce la óptica, la cual se conecta al sistema de endocámara y éste a un monitor ubicado al frente del cirujano y ayudante.
Es recomendable usar dos monitores para mejorar la ergonomía del acto quirúrgico. Se insufla CO2 para crear un neumoperitoneo adecuado (presión máxima de 15 mmHg). Después de realizar un detallado reconocimiento de los órganos abdominales, la paciente se coloca en posición de Trendelemburg (30°), para facilitar el reconocimiento de los órganos pélvicos, rechazo de las asas intestinales y la movilización del útero.
Se introducen los dos trócares de trabajo laterales a los vasos epigástricos inferiores, a la altura de la espina ilíaca antero superior, a unos 2 cm por dentro de las mismas. Se puede usar un tercer trocar operatorio en el hipogastrio por vía suprapúbica en línea media, y debe situarse de manera que forme un triangulo con los otros trócares. Para mejorar la ergonomía del cirujano pueden usarse cuatro trócares laterales de trabajo, dos en las zonas anteriormente citadas y otros dos más altos y mediales. Todos ellos se situarían en un arco imaginario que tiene como extremos las espinas iliacas anterosuperiores y como vértice el ombligo. El uso de cuatro trócares es interesante si se realiza una histerectomía por cáncer ginecológico, ya que esta disposición permite realizar, si es preciso, una linfadenectomía pélvica más cómodamente.
Fig. 1. Disposición de los trócares durante una histerectomía laparoscópica. El trocar central está situado en el ombligo.
Fig. 2. Identificación del ligamento redondo.
Figura 1. Figura 2.
Fig. 3. Apertura del ligamento ancho (lado izquierdo). Esta maniobra permite acceder a las estructuras pélvicas para identificarlas mejor antes de proceder a la sección de las estructuras
Fig. 4. Disección del ligamento redondo y visualización de las estructuras pélvicas: vasos iliacos y uréter (lado izquierdo).
Figura 3. Figura 4.
Fig. 5. Electrocoagulación y disección del ligamento redondo respectivo, a una distancia de 3 cms del útero. En este caso con Ligasure® (lado izquierdo). Este paso permite abrir completamente el ligamento ancho exponiendo la plica vesicouterina, los vasos uterinos y las estructuras anexiales.
Fig. 6. Identificación y electrodisección de la parte proximal de la trompa uterina. Este procedimiento se realiza sólo en caso de conservación de anejos (lado izquierdo).
Figura 5. Figura 6.
Fig. 7. Electrocoagulación y sección del ligamento útero-ovárico y el mesosalpinx (solo en caso de conservación de anejos).
Fig. 8. Apertura del peritoneo de la plica vesico-uterina.
Figura 7. Figura 8.
Fig. 9. Disección y rechazo de la plica vesico-uterina. Este paso es importante ya que permite acceder a la cara anterior de la vagina y porque es aquí donde se producen la mayoría de las lesiones vesicales.
Fig. 10. Identificación de la arteria uterina derecha.
Figura 9. Figura 10 .
Fig. 11. Electrocoagulación de la arteria uterina derecha con Ligasure®
Figura 11.
Figs. 12 y 13. Disección del peritoneo del Douglas y sección del ligamento uterosacro derecho con Ligasure®
Figura 12. Figura 13 .
Fig. 14. Electrodisección del ligamento cardinal izquierdo con Ligasure® e instrumento monopolar. Este procedimiento puede ser sangrante por la alta vascularización de los parametrios y en cuellos hipertróficos.
Fig. 15. Apertura del fondo vaginal posterior con tijera monopolar ayudado por el manipulador vaginal. En este caso el manipulador protruye la vagina identificando el sitio de corte y evitando la lesión del recto.
Figura 14. Figura 15 .
Fig. 16. Apertura completa del fondo de saco vaginal haciendo procidencia el manipulador vaginal (en este caso un amnioscopio).
Fig. 17. Identificación del fondo de saco vaginal anterior con ayuda del manipulador vaginal y posterior sección con instrumento monopolar hasta la visualización del manipulador vaginal. Este paso precisa de una buena disección de la plica vesicouterina para evitar lesiones vesicales.
Figura 16. Figura 17 .
Para terminar de cortar la vagina se ubica el manipulador en los fondos de saco vaginales, para permitir una correcta visión de la unión cérvico-vaginal. Con la tijera monopolar se procede cortando la vagina girando el manipulador en relación con el sentido del corte. Una vez separado el útero de la vagina se procederá a la extracción vía vaginal del útero. A continuación se realiza el cierre de la cúpula vaginal con sutura reabsorbible vía laparoscópica y revisión de la hemostasia. Finalmente, se debe comprobar la integridad de ambos uréteres y realizar una revisión del campo quirúrgico
CLASE 4

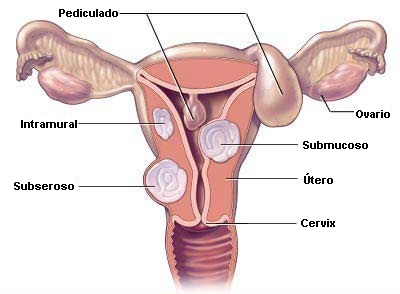
TRATAMIENTO

CLASE 4
MIOMECTOMIA LAPAROSCOPICA
La miomatosis uterina es el
tumor benigno más frecuente en el aparato genital femenino. La prevalencia es
de hasta el 50 % en algunas poblaciones y los síntomas aparecen con mayor
frecuencia durante la paramenopausia. La mayoría de las mujeres con miomatosis
uterina no requieren tratamiento alguno ya que los miomas son frecuentemente
asintomáticos, sin embargo cuando son sintomáticos la miomectomía es una opción
valedera como tratamiento conservador.
TIPOS DE MIOMAS
TIPOS DE MIOMAS

TRATAMIENTO
TERAPIA HORMONAL PREOPERATORIA
Algunos trabajos plantean el
uso de análogos del GnRH en el preoperatorio con el fin de disminuir el tamaño
uterino, lográndose una reducción del volumen del mismo entre un 35-50%. Esta
reducción se alcanza luego de un tratamiento de 12 semanas y no se obtienen
mejoras en los resultados con un tratamiento más prolongados.
TECNICA QUIRURGICA
CONSIDERACIONES TÉCNICAS
La ML consiste en tres fases : escisión del mioma, reparación del miometrio y extracción de la pieza.
ESCISIÓN DEL MIOMA
Los miomas pediculados no plantean mayores dificultades.
Los miomas subserosos sesiles y los intramurales son los más dificultosos.
En general la primer etapa consiste en la inyección en la serosa de vasopresina que disminuye el sangrado intraoperatorio aunque pueden pasar desapercibidas zonas que más tarde ocasionen sangrado. Además tiene graves complicaciones sistémicas si se inyecta intravascular en forma accidental.
El próximo paso es la incisión de la serosa. No hay consenso si ésta debe ser vertical u horizontal, y hay autores que defienden una u otra técnica argumentando los dos grupos que facilita la sutura laparoscópica mejorando el cierre miometrial.
El lecho debe ser coagulado con bisturí bipolar teniendo la precaución de no coagular en forma extensa ya que predispone a la necrosis, dificulta la cicatrización y puede predisponer a rotura uterina posterior.
Puede instilarse azul de metileno en la cavidad uterina para corroborar la indemnidad del endometrio.
EXTRACCION DE LA PIEZA
Con el advenimiento de la técnica de ML, la extracción de la pieza ha cobrado especial interés, dado que muchas veces es responsable de la prolongación del tiempo operatorio perjudicando el costo beneficio de la cirugía laparoscópica . Cualquiera sea la técnica de remoción de la pieza, ésta no debe comprometer la seguridad del paciente ni en el intra ni en el postoperatorio.
Dado que en la mayoría de los casos no es posible extraer la pieza de miomectomía a través de la incisión realizada para un trócar de 5 mm, es necesario ampliar la misma, con lo que la posibilidad de hernias se incrementa.
Previo al surgimiento del morcelador de Storz la extracción de piezas grandes requería la reducción de la misma con tijera y extracción en múltples veces, lo que convertía al procedimiento en tedioso y aumentaba el riesgo de daño de la fascia y de las consiguientes hernias, a pesar del cierre rutinario de la fascia.
Actualmente no se han reportado la aparición de hernias y esto se atribuye fundamentalmente a la aparición y uso de morceladores que permite transformar el mioma en trozos pequeños que se extraen sin dificultad. De todas formas no está exenta de riesgos, ya que es un instrumento con alto poder de corte y hay que ser cauteloso para no dañar tejidos vecinos
COLPATOMIA Vs MORCELACION
En contraposición hay quienes consideran la colpotomía como innecesaria, y proponen la morcelación. Argumentan que la colpotomía expone a la paciente a numerosos riesgos como ser: infección, lesión de órganos vecinos, adherencias, dispareunia, formación de granulomas, y compromiso de la fertilidad por aumento de adherencias en el fondo de saco de Douglas.
La ML consiste en tres fases : escisión del mioma, reparación del miometrio y extracción de la pieza.
ESCISIÓN DEL MIOMA
Los miomas pediculados no plantean mayores dificultades.
Los miomas subserosos sesiles y los intramurales son los más dificultosos.
En general la primer etapa consiste en la inyección en la serosa de vasopresina que disminuye el sangrado intraoperatorio aunque pueden pasar desapercibidas zonas que más tarde ocasionen sangrado. Además tiene graves complicaciones sistémicas si se inyecta intravascular en forma accidental.
El próximo paso es la incisión de la serosa. No hay consenso si ésta debe ser vertical u horizontal, y hay autores que defienden una u otra técnica argumentando los dos grupos que facilita la sutura laparoscópica mejorando el cierre miometrial.
El lecho debe ser coagulado con bisturí bipolar teniendo la precaución de no coagular en forma extensa ya que predispone a la necrosis, dificulta la cicatrización y puede predisponer a rotura uterina posterior.
| Figura 1 - Técnica de miomectomía laparoscópica . Mioma intramural histerotomía transversa utilizando bisturí monopolar o fibra laser. (Extraído de Milad). | |
| Figura 2 - Disección del mioma (extraído de Milad). | |
| Figura 3 - Coagulación del mioma con bipolar (extraído de Milad) |
REPARACIÓN DEL MIOMETRIO
Si se trata de un mioma pequeño y superficial y la paciente no desea futuros embarazos los bordes del defecto uterino son hemostasiados sin cierre miometrial. Sin embargo si la paciente desea futuros embarazos, el miometrio debe ser suturado en varios planos con sutura reabsorbible. Por este motivo la ML debe reservarse para los endoscopistas más familiarizados con la técnica de sutura endoscópica.Puede instilarse azul de metileno en la cavidad uterina para corroborar la indemnidad del endometrio.
| Figura 4 - Sutura del miometrio (extraído de Mliad). |
Con el advenimiento de la técnica de ML, la extracción de la pieza ha cobrado especial interés, dado que muchas veces es responsable de la prolongación del tiempo operatorio perjudicando el costo beneficio de la cirugía laparoscópica . Cualquiera sea la técnica de remoción de la pieza, ésta no debe comprometer la seguridad del paciente ni en el intra ni en el postoperatorio.
Dado que en la mayoría de los casos no es posible extraer la pieza de miomectomía a través de la incisión realizada para un trócar de 5 mm, es necesario ampliar la misma, con lo que la posibilidad de hernias se incrementa.
Previo al surgimiento del morcelador de Storz la extracción de piezas grandes requería la reducción de la misma con tijera y extracción en múltples veces, lo que convertía al procedimiento en tedioso y aumentaba el riesgo de daño de la fascia y de las consiguientes hernias, a pesar del cierre rutinario de la fascia.
Actualmente no se han reportado la aparición de hernias y esto se atribuye fundamentalmente a la aparición y uso de morceladores que permite transformar el mioma en trozos pequeños que se extraen sin dificultad. De todas formas no está exenta de riesgos, ya que es un instrumento con alto poder de corte y hay que ser cauteloso para no dañar tejidos vecinos
COLPATOMIA Vs MORCELACION
En contraposición hay quienes consideran la colpotomía como innecesaria, y proponen la morcelación. Argumentan que la colpotomía expone a la paciente a numerosos riesgos como ser: infección, lesión de órganos vecinos, adherencias, dispareunia, formación de granulomas, y compromiso de la fertilidad por aumento de adherencias en el fondo de saco de Douglas.
| Figura 5 - Morcelador electrónico de 12 mm Steiner y Storz, y otro de 15 mm Gynecare Johnson & Johnson (extraído de Milad). |
RESULTADOS REPRODUCTIVOS
Los índices de fertilidad luego de la ML son similares a los de la laparotomía . Aproximadamente 55% de las mujeres infértiles a las que se les realizó ML lograron un embarazo posterior
TERCER CORTE
CLASE 1
INFERTILIDAD
Tipos y consecuencias del tratamiento de obstrucción de trompas. Laparoscopía
Las trompas uterinas unen el ovario con el útero, y el óvulo maduro, moviéndose de ovario, se fertiliza por el espermatozoide precisamente en la trompa. Después la trompa hace pasar el óvulo al útero. La obstrucción de las trompas uterinas es una de las causas de infertilidad femenina.
La obstrucción puede ser consecuencia de:
Operación a los órganos de pelvis pequeña (incluso apendicetomía);
inflamación (la más frecuente es infección por clamidias).
La obstrucción puede suceder no sólo en la trompa misma sino entre el ovario y la trompa como adherencia (aglutinación de las paredes de las trompas uterinas y de ovarios).
Adherencia de la trompa uterina
El tratamiento conservador (sin cirugía) se usa cuando la obstrucción es causada por procesos inflamatorios. En este caso se prescriben los fármacos antiflogísticos, el tratamiento fisiológico, pero en caso de adherencias este tratamiento es poco eficaz.
El tratamiento operatorio es una intervención quirúrgica. Como regla, el tratamiento operatorio se hace usando el método de laparoscopía — casi no provoca complicaciones. Pero nadie puede dar 100% de probabilidad de curación de infertilidad, relacionada con la disfunción de permeabilidad de las trompas uterinas. La excisión de las trompas uterinas es una medida extrema y se usa sólo en casos excepcionales.
¿Cómo se puede examinar la permeabilidad de las trompas uterinas?
El examen de permeabilidad de las trompas uterinas puede ser realizado con varios métodos:
laparoscopía diagnostica (el examen de permeabilidad de las trompas uterinas se hace, como regla, durante las excisiones de adherencias — laparoscopía no se prescribe, como regla, sólo para examinar las trompas)
HSG (histerosalpingografía, MSG, metrosalpingografía — otras denominaciones);
hidrosonografía (ecografía);
fertiloscopia (método, parecido a laparoscopía; a menudo se combinan). La diferencia entre fertiloscopia y laparoscopía consiste en que los instrumentos se introducen no por la pared abdominal, sino por la vagina.
¿Cómo se puede examinar la permeabilidad de las trompas uterinas, qué método elegir?
Teniendo en cuenta que la laparoscopía y la fertiloscopia son métodos traumáticos y la ecografía no presenta un cuadro claro de lo que está sucediendo, HSG en la mayoría de los casos es el métodoо óptimo.
HSG, o histerosalpingografía
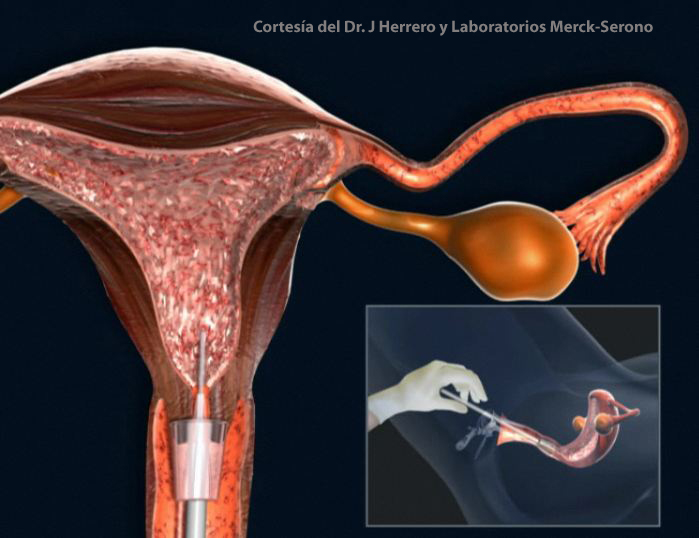
La histerosalpingografía (HSG) es un examen radiográfico de las trompas uterinas para permeabilidad. La histerosalpingografía es una etapa importante en el examen de la mujer con el diagnóstico de «infertilidad». La precisión del examen es no menos que 80%.
La histerosalpingografía permite diagnosticar:
condición de de la cavidad uterina y presencia de patología del endometrio — pólipo del endometrio;
presencia de deformaciones del desarrollo de las vísceras y del útero, por ejemplo útero arcuato, tabique intrauterina, útero bicorne, etc.
¿Cómo se realiza el examen de permeabilidad de las trompas uterinas con HSG?
Al cuello uterino se introduce un agente de contraste — solución de añil. Llena la cavidad uterina y entra en las trompas, de ellas pasa a la cavidad abdominal. Al mismo tiempo se hace una radiografía, que muestra la condición de la cavidad uterina y de las trompas uterinas.
En la mayoría de los casos este procedimiento no sólo ayuda a evaluar la permeabilidad de las trompas uterinas, sino también permite ver la presencia de deformación de la trompa:
extensión;
ondulación;
constricciones, etc.
La histerosalpingografía puede ser realizada sólo sin inflamaciones. Antes de comenzar el examen, se hacen los análisis para VIH, hepatitis В y С, sífilis y citología general. HSG no exige anestesia general.
Como regla, las mujeres, que tratan de quedarse embarazada, hacen la histerosalpingografía al 5–9-o día del período menstrual, si su duración es de 28 días. Si la mujer se preserva contra el embarazo, el examen se puede hacer cualquier día del ciclo menos la menstruación.
Desventajas de histerosalpingografía
El procedimiento es bastante desagradable.
Los órganos de pelvis pequeña se quedan irradiados.
Tras HSG durante un período menstrual hay que preservarse.
Ecografía de permeabilidad de las trompas uterinas
La ecografía de permeabilidad de las trompas uterinas (hidrosonografía) es una alternativa de histerosalpingografía. La ecografía tiene unas ventajas ante HSG:
es un procedimiento menos desagradable;
a diferencia de HSG, no se usa irradiación que puede afectar negativamente la salud de reproducción de la mujer;
cuando tras HSG hay que preservarse, la ecografía de permeabilidad de las trompas uterinas es segura.
La desventaja principal del procedimiento es que los resultados son menos exactos que los de HSG.
¿Cuándo se hace la ecografía de permeabilidad de las trompas?
La ecografía de permeabilidad de las trompas suele hacerse en vísperas de la ovulación: durante este tiempo la probabilidad de espasmo es menor y el canal del cuello uterino está dilatado. A diferencia de histerosalpingografía, no es muy importante qué día del ciclo hacer la ecografía de permeabilidad. Antes del examen de permeabilidad de las trompas uterinas, hay que hacer unos análisis, para excluir las enfermedades inflamatorias.
¿Cómo se hace la ecografía de permeabilidad de las trompas uterinas?
El método de ecografía de permeabilidad de las trompas uterinas es caso indoloro. Por el cuello uterino a la cavidad uterina se introduce un catéter especial, bajo el control de ecografía en él se vierte la solución fisiológica templada. Si entra en las trompas uterinas, las trompas son permeables. Si no — es probable su obstrucción.
Desventajas de la ecografía de permeabilidad de las trompas uterinas:
las cantidades respectivamente grandes del líquido y los espasmos del útero y de las trompas uterinas pueden provocar unas sensaciones desagradables;
si ecografía indica que la solución fisiológica no entra, no siempre significa la obstrucción de las trompas. Puede suceder por un espasmo fuerte.
Laparoscopía. ¿Cómo examinar la permeabilidad de las trompas uterinas con este método?
La laparoscopía es un método quirúrgico de evaluación de permeabilidad de las trompas uterinas. Mediante las punciones en la pared abdominal con unos aparatos ópticos se hace el examen de los órganos internos. Si le está prescrita la laparoscopía, el foro puede ayudarle a elegir una clínica o hasta a un cirujano.
La laparoscopía diagnostica se hace para evaluar la condición de la superficie externa de las trompas uterinas y los órganos de pelvis pequeña y para detectar sus patologías.
Las operaciones más frecuentes son:
laparoscopía de ovarios;
laparoscopía de las trompas uterinas;
laparoscopía de los órganos de la cavidad abdominal.
Laparoscopía de ovarios

La laparoscopía de ovarios permite eliminar el quiste y la adherencia, devolver a la mujer la posibilidad de tener hijos. Dentro de un par de días tras la laparoscopía del quiste de ovario, este vuelve a sus límites normales y restablece sus funciones por completo.
El dolor tras la laparoscopía se observa muy raramente, las suturas se cierran bastante rápidamente sin molestar, — los anestésicos se toman en los casos extremos, según la prescripción del médico.
La laparoscopía del quiste de ovario no es una operación fácil. Elija un médico bueno, porque muy a menudo la aparición de quistes en el futuro y la posibilidad del embarazo dependen del esmero de la operación.
Laparoscopía del útero
La laparoscopía del útero es el método más eficaz del tratamiento de mioma. La operación se prescribe también para el tratamiento de diferentes fracasos del desarrollo del útero.
Laparoscopía de mioma del útero
Los factores determinantes de elección del tipo del tratamiento de mioma del útero son: la intención de tener hijos en el futuro, el tamaño del útero, el tamaño de los nódulos miomatosos, su posición. Laparoscopía es una buena opción para eliminar un mioma de tamaño pequeño.
La laparoscopía de mioma del útero no se hace en los casos siguientes:
el tamaño del útero es más grande que el feto en la semana 11–12 del embarazo;
se desarrollaron nódulos miomatosos múltiples;
el tamaño de los nódulos es grande;
los nódulos de mioma se sitúan bajo.
En estos casos es mejor recurrir a otros métodos de eliminación, por ejemplo laparotomía.
El tratamiento de las trompas uterinas con laparoscopía

La laparoscopía de las trompas es un método, cuando se usa la narcosis, y los espasmos son imposibles. Por eso el examen de las trompas con laparoscopía da los resultados más exactos. La laparoscopía de las trompas uterinas permite eliminar las adherencias. La laparoscopía se prescribe cuando es necesario el tratamiento de las trompas uterinas y sus patologías.
La laparoscopía de las trompas puede prescribirse en los casos siguientes:
adherencias de las trompas uterinas;
embarazo extrauterino;
obstrucciónи de las trompas uterinas;
diagnóstico de infertilidad femenina;
endometriosis;
esterilización.
Tras la laparoscopía, se puede quedarse embarazada durante unos meses, pero inmediatamente tras la operación hay que negarse por completo de contactos sexuales para 2-3 semanas. Después se puede planear la concepción. El embarazo tras laparoscopía es posible muy pronto.
Las mujeres que se quedaron embarazadas tras unos meses después de laparoscopía, visitan al ginecólogo. A menudo el embarazo se acompaña por el tratamiento medicinal, la mujer toma los fármacos para mantener el fondo hormonal normal del embarazo. Si el embarazo tras laparoscopía no llega, se puede repetir la operación varias veces.
¿Vale la pena restablecer la permeabilidad de las trompas?
Se puede quedarse embarazada aproximadamente durante un año después de restablecimiento de la permeabilidad de las trompas — es muy alta la probabilidad de que pronto vuelva a haber obstrucción. Además la trompa debe ser no sólo permeable: debe dejar pasar el óvulo fecundizado al útero. Si no lo hace, se forma el embarazo extrauterino.
Cualquier operación de restablecimiento de la permeabilidad de las trompas aumenta el riesgo del embarazo extrauterino. Por eso el restablecimiento de la permeabilidad no garantiza que Usted podrá quedarse embarazada. Además, cualquier operación puede provocar el proceso de formación de adherencias.
Si Usted es joven y no hay más factores que impiden quedarse embarazada, la operación a las trompas tiene sentido. Si tiene más de 35 años y hace mucho tiempo que trata de quedarse embarazada sin resultados, piense en fecundación asistida. Con cada ovulación ¨la calidad¨ de óvulos se empeora, y no hay que perder meses a restablecer las trompas El tiempo juega en su contra. En vista de lo antes escrito, consúltese con su médico para saber si vale la pena restablecer la permeabilidad de las trompas.
CLASE 2
ESTERILIZACION
La esterilización quirúrgica
(EQ), ya sea mediante abordaje abierto o endoscópico, es un procedimiento cada
vez más utilizado por parejas estables que han completado el número de hijos
deseados y que quieren llevar una vida sexual sin temor al embarazo
Las técnicas de EQ se
clasifican en endoscópicas y no endoscópicas
TÉCNICAS NO ENDOSCÓPICAS
- · Laparotomía
- · Madlener
- · Pomeroy
- · Ushida
- · Parkland
- · Irving
- · Kröener
- · Electrocoagulación tubaria
- · Dispositivos oclusivos *
- · Clip de Hulka
- · Anillo de Yoon
- · Clips de Filshie
- ·
Colpotomía
- · Madlener
- · Pomeroy
- · Dispositivos oclusivos *
Otras
técnicas
- · Cooke
- · Histerectomía
- · Salpingectomía
TÉCNICAS ENDOSCÓPICAS
Laparoscopia
- · Electrocoagulación tubaria
- · Dispositivos oclusivos *
- · Madlener
- · Pomeroy, etc.
Culdoscopia
(iguales a la laparoscopia)
Histeroscopia
- · Electrocoagulación
- · Instilación de agentes esclerosantes
- · Oclusión mecánica
El perfeccionamiento y
miniaturización de los sistemas ópticos y de iluminación han conducido al uso
cada vez más frecuente de los métodos endoscópicos para realizar la EQ. La vía
de abordaje puede ser: abdominal por laparoscopia, vaginal por culdoscopia o intrauterina
por histeroscopia
La
laparoscopia constituye la técnica ideal en el intervalo y aunque se puede
utilizar en el puerperio, no es muy recomendable porque el útero está aumentado
de tamaño y las trompas están muy vascularizadas y edematizadas
Culdoscopia
Se
introduce un sistema óptico a través del fondo de saco de Douglas, para
realizar una electrocoagulación de las trompas, la aplicación de anillos o
clips. También se pueden tomar las trompas con unas pinzas largas, extraerlas
hacia la vagina, y proceder a la ligadura por las técnicas de Madlener, Pomeroy
o Kröener. Es una operación sencilla que se puede hacer sin hospitalización, tolerable
bajo anestesia local y que no deja cicatriz visible, aunque cada día se realiza
menos porque requiere de una gran habilidad por parte del operador.
Histeroscopia
Consiste en la introducción de un sistema óptico a través del cuello uterino y
una vez visualizado el ostium tubárico realizar la EQ. Se han descrito dos
tipos de técnicas transcervicales. 1. Las destructivas, en las que el segmento
intramural de la trompa es destruido por electrocirugía o agentes esclerosantes
como gelatina de formaldehido, nitrato de plata, quinacrina y metilcianocrilato
(El Kady et al, 1993; Berkey et al, 1995). 2. La oclusión mecánica del ostium
tubárico mediante tapones u otros dispositivos (Zatuchni et al, 1983).
TIPOS
DE ESTERILIZACION ENDOSCOPICA
Electrocoagulación
El principio de esterilización
con esta técnica se basa en la capacidad que tienen los electrones generados
por una unidad electroquirúrgica de ser concentrados en un lugar, aumentando
drásticamente el calor en el tejido con lo cual se diseca hasta llegar a un
máximo de resistencia en el que no hay más flujo de corriente.
La electrocoagulación puede
ser de dos tipos.
• MONOPOLAR.
Con esta técnica la paciente
requiere de una placa/tierra para que la co-rriente pase del electrodo colocado
en la pinza hasta la placa. El equipo crea un área de alta concentración de
electrones en la punta de la pinza del electrodo que está en contacto con la
trompa. Para completar el circuito, los electrones viajan a través del cuerpo y
regresan al generador por vía de un electrodo de retorno.
·
BIPOLAR.
Esta técnica elimina la necesidad
de la placa/tierra y utiliza pinzas especiales diseñadas para ello. Una
mandíbula de la pinza tiene el electrodo activo y la otra es la placa/tierra.
La densidad de corriente es alta en el punto de contacto de la pinza con el
tejido y el uso de una co-rriente de bajo voltaje y alta frecuencia previene la
disipación de los electrones. Además, el tejido desecado puede adherirse a la
pinza bipolar lo cual dificulta la separación de la misma de la superficie
tubárica ocasionando desgarros y la posibilidad de hemorragias. La técnica de
esterilización tubaria, tanto monopolar como bipolar, puede ser de tres formas
diferentes
.
• Electrocoagulación. Mediante la cual se pasa la corriente eléctrica
hasta que el tejido toma una coloración blanquecina. De esta manera se produce
una coagulación de las proteínas de las células de la trompa produciendo
oclusión de su luz.
• Electrocoagulación y sección. El procedimiento anterior se puede
complementar mediante sección de la zona de tejido coagulada.
• Electrocoagulación, sección y remoción. Se puede practicar la
electrocoagulación y sección a ambos lados de la pinza, mediante una tijera
especial, y remoción de una parte de la trompa. Esta última es la técnica más
recomendable y la que estadísticamente ha dado mejores resultados, aunque es la
más laboriosa.
OCLUSIÓN
MECÁNICA
Con estos métodos se evitan
los problemas accidentales de la corriente eléctrica, pero requieren un dominio
de la técnica para aplicar el clip o el anillo y una atención meticulosa para
el cuidado de los instrumentos. Además, está sujeta a las fallas de fabricación
de los objetos que se aplican
.
• Clips
de Hulka-Clemens.
Este clip consta de dos
mandíbulas hechas de lexan, sostenidas en un extremo por un pequeño dispositivo
de metal de 2 mm. Cada mandíbula muerde la superficie opuesta con unos dientes
que tienen en su superficie interna y luego un resorte de acero es empujado
sobre las mandíbulas para sostenerlo cerrado sobre la trompa (Hulka et al,
1976). Tiene la ventaja que el segmento tubárico destruido es tan sólo de 3 mm,
ofreciendo una mejor oportunidad para la reanastomosis que cuando se usa la
electrocoagulación. Tiene una tasa de fracasos de 2/1 000, aunque una tasa
acumulada para 10 años más alta (Chi, 1980).
• Anillos de Yoon.
Se basa en la colocación de un
anillo de silastic que es totalmente inerte, en un segmento tubárico de 2 a 3
cm. El anillo tiene una memoria elástica del 100%, mide 6 mm de diámetro y
puede ser colocado con una o dos punciones. El aplicador del clip consiste en 2
cilindros concéntricos, dentro del cilindro interno hay una pinza para agarrar,
elevar y retraer un segmento tubárico. El anillo de silastic está colocado en
el extremo distal expuesto del cilindro interno y el cilindro externo mueve el
anillo desde el cilindro interno hacia la trompa que está sostenida por la
pinza. El anillo se coloca en la unión del tercio proximal con el tercio medio,
ocluyendo una porción tubárica de aproximadamente 2,5 cm. Tiene una tasa de
fracasos de 1,4/1 000 (Yoon, 1977). La principal complicación es el desgarro y
sangrado del mesosalpinx. Esto ocurre cuando la pinza agarra parte del meso
tubárico y lesiona los vasos sanguíneos
Clips
de Filshie.
Es un clip hecho de titanio y
sus ramas están recubiertas, en su superficie interna, con silicón. Pesa 0,32 g
y mide 12,7 mm de largo por 4 mm de espesor. Es radio-opaco y consta de 2 ramas
articuladas, la inferior es curva en su extremo distal de forma que aprisione
la rama superior cuando se cierra sobre la trompa. Esta rama está provista de
un tallo plástico, de manera que el operador lo inserte en el aplicador sin tocar
el clip. El segmento tubárico destruido mide sólo 4 mm y el clip se coloca
aproximadamente a 1-2 cm del cuerno (fig. 11-7). Tiene la ventaja que puede
incluir trompas con mayor espesor que lo normal, y, al igual que el de Hulka,
no producir mucha lesión ni remoción de trompa, lo cual hace más fácil una
eventual reanastomosis (Navarrete et al, 1992). La falla del método se ha
seña-lado entre un 2 y 4/1 000 mujeres (Filshie et al, 1981). La principal
complicación es la caída del clip, en cuyo caso se procede a colocar uno
adicional y se deja el otro en el abdomen.
CLASE 4
CIRUGIA ROBOTICA
¿Qué es la cirugía robótica?
La Cirugía Robótica también conocida como cirugía laparoscópica asistida por robot, es una técnica en la cual un cirujano lleva a cabo la cirugía usando una consola que controla de manera remota instrumentos muy pequeños fijados a un robot.
Este procedimiento se hace bajo anestesia general (usted está dormido y sin dolor). El cirujano se sienta en una estación al lado del paciente (consola del cirujano) y dirige los movimientos del robot. Otra parte del sistema consiste en una mesa (consola del paciente) con una torre y brazos robóticos a los cuales se fijan los instrumentos quirúrgicos.
Primero el cirujano introduce los instrumentos en el cuerpo del paciente a través de pequeñas incisiones. Siempre bajo la dirección del cirujano, el robot replica los movimientos de la mano del médico para llevar a cabo el procedimiento.
Un tubo delgado con una cámara adherida a su extremo (endoscopio) le permite al cirujano visualizar imágenes tridimensionales y en formato HD del interior del cuerpo, altamente ampliadas en un monitor y en tiempo real.
¿Quiénes pueden practicarla?
Únicamente pueden operar los cirujanos que han tenido un proceso de entrenamiento, apoyados por el Hospital y la Institución de Intuitive, para su certificación.
Beneficios
La cirugía robótica otorga muchos beneficios, como lo son:
- Recuperación más rápida.
- Considerablemente menos dolor.
- Menor riesgo de infección.
- Poca pérdida de sangre.
- Menos transfusiones.
- Cicatrices más pequeñas.
- Regreso pronto a las actividades cotidianas.
- Corta estancia hospitalaria.
- Menor riesgo de complicaciones.
Ventajas de la cirugía robótica
En lo que respecta a la cirugía:
- Precisión, ya que elimina cualquier temblor del cirujano.
- Destreza, el cirujano con la ayuda de la tecnología puede desenvolverse mejor y más cómodo durante el procedimiento.
- Control, el cirujano tiene más control sobre la cirugía.
- Mejor visualización, al ser ésta en tercera dimensión y en formato HD.
- Mayor alcance de movimientos, los brazos del robot pueden rotar hasta 360°.
- Mejor acceso a las cavidades, los instrumentos del robot al ser tan diminutos, pueden llegar a áreas del cuerpo más lejanas y de difícil acceso.
La actividad de la enfermería en el quirófano robótico es crucial, ya que depende de ellos la preparación del mismo y la puesta a punto del equipo Da Vinci y del instrumental antes del inicio de la intervención, así como los cambios de instrumental y la atención a todos los detalles durante el desarrollo de la misma.
La importancia de la enfermería, dentro de un equipo de cirugía robótica, radica en su papel dentro del mismo para facilitar el desarrollo y el perfeccionamiento de los procedimientos de las diversas especialidades, participando en el aprendizaje con los cirujanos implicados, y también en su posibilidad de colaborar en la formación de otros profesionales y en la difusión de los resultados obtenidos con la tecnología robótica.
El personal de enfermería como miembro del equipo de cirugía robótica del HCSC realiza tres funciones fundamentales:
Función asistencial
Función docente
Labor de difusión.
Es muy importante que los profesionales que componen el equipo de enfermería de cirugía robótica tengan experiencia previa en cirugía laparoscópica y que estén familiarizados y tengan los conocimientos necesarios para la realización de las diversas técnicas quirúrgicas en las distintas especialidades en las que se desarrolla la cirugía robótica dentro de nuestro hospital.
FUNCION ASISTENCIAL
Actividades previas a la llegada del paciente a quirófano
Correcta colocación del quirófano (Fig.1).
El quirófano donde se encuentra el robot Da Vinci es multifuncional: en él se llevan a cabo diferentes tipos de intervenciones de Cirugía General, Urología y Ginecología, de acuerdo con el desarrollo del Plan de Cirugía Robótica del Hospital.Antes de cada intervención hay que colocar correctamente tanto los elementos habituales del quirófano (carro de anestesia, mesa quirúrgica, bisturís eléctricos, sistemas de aspiración y mesas auxiliares), como los distintos elementos del robot Da Vinci, ya que dependiendo del procedimiento a realizar los brazos del robot entrarán por un lado u otro del paciente y la torre de visión irá colocada en función del lado de entrada de los brazos.
Figura 1. Disposición del mobiliario de quirófano en cirugía robótica
Chequeo del sistema
Una vez conectados todos los elementos del sistema se procede a su encendido y en ese momento el sistema se autochequea, este proceso dura unos segundos y después el sistema esta listo para operar.
La importancia del autochequeo radica en el poder que tenemos para detectar cualquier tipo de problema del sistema y poder actuar de forma rápida y eficaz antes de iniciarse la intervención propiamente dicha.
Durante la inducción anestésica
Se lleva a cabo mediante una serie de fundas de plástico estériles e individuales para cada brazo, en este caso las fundas de los brazos de instrumental son diferentes a las fundas del brazo de la cámara.Es una tarea sencilla pero se necesita la colaboración del enfermer@ circulante. Una vez enfundados y estériles, los brazos del Da Vinci se sitúan de modo que la circulación dentro del quirófano no pueda contaminarlos y estén listos para su colocación sobre el paciente al inicio de la intervención.
Calibración de la ópticaSe realiza seleccionando en el interface de la consola del cirujano el tipo de endoscopio que se va a utilizar durante la intervención (puede ser de 0º o de 30º, y en este último caso, con el bisel hacia arriba o hacia abajo). Además se hace balance de blancos y negros y se ajusta el enfoque de la cámara.
Figura 2. Vestido del robot
Durante la intervención quirúrgica
Inicio de la I.Q.
El enfermer@ instrumentista colabora en la preparación del campo quirúrgico y el inicio de la propia intervención quirúrgica por laparoscopia, que suele realizarse mediante abordaje abierto en nuestro medio, con realización del neumoperitoneo y la exploración inicial laparoscópica del campo quirúrgico, así como la introducción de los trócares del robot y auxiliares.
Instrumentación durante la I.Q.(Fig.3)
La instrumentación por parte de la enfermería en la cirugía robótica es muy parecida a la laparoscópica. La única diferencia es que se intercambian los instrumentos directamente al robot, no al cirujano.
Finalización laparoscópica de la I.Q.Una vez acabada la cirugía robótica el procedimiento finaliza con cirugía laparoscópica de la forma habitual con revisión de la hemostasia y la visión de la salida de los trócares de la cavidad abdominal.
Figura 3. Instrumentación durante la cirugía
Instrumental Da Vinci
Todos los instrumentos del sistema DaVinci tienen un diámetro de 8 mm y se componen de tres partes bien diferenciadas que no se pueden separar entre sí (Fig.4):
Carcasa (parte ancha del instrumento). Es por donde el instrumento se ajusta al brazo del robot
Cánula del instrumentoPunta del instrumento. Los diferentes instrumentos se diferencian únicamente en la punta, que es la parte de los mismos que imita el movimiento de las manos del cirujano.
Figura 4. Instrumento del robot
Trócares y ópticas Da Vinci
Los trócares propios del robot son metálicos (por lo tanto reutilizables), de 8 mm de diámetro, con obturadores romos y afilados (Fig.5). Están diseñados de manera que, una vez colocados, se ensamblan al brazo del robot mediante una pieza que está ajustada al mismo, para permitir el paso del instrumento a su través.
El inicio de la intervención se realiza mediante abordaje laparoscópico, con un trócar romo de Hasson sin su elemento de fijación (ya que el trócar será fijado por el brazo del robot). En todas las intervenciones se colocan uno o dos trócares auxiliares (para ser manejados por los cirujanos que están en la mesa, asistiendo al cirujano de la consola). Los trócares del robot pueden telescoparse, introduciéndose dentro de trócares de 10-12 mm., lo que puede ser muy útil en algunas intervenciones.
Una colocación correcta de los trócares es muy importante para el desarrollo adecuado de la intervención, igual que ocurre en la cirugía laparoscópica, y también para que el posicionamiento de los brazos del robot no sea complejo.
Figura 5. Trócares y obturadores robóticos
Las ópticas disponibles para el Da Vinci son de 10 mm tanto de 0º como de 30º, con dos lentes que es lo que confiere la visión tridimensional en la consola del cirujano(Fig.6).
Figura 6. Optica del Da Vinci
En todas las intervenciones robóticas se puede necesitar instrumental que no está disponible en el Da Vinci en la actualidad, como aspiradores-irrigadores, aplicadores de clips, máquinas de sección y sutura mecánica o instrumentos de sellado vascular como el Ligasure. Por este motivo, hay que disponer en estas intervenciones de acceso a la cavidad desde la mesa, por parte de los cirujanos que están en la misma, mediante trócares auxiliares de 10/12 mm de laparoscopia desechables. Además, es necesario tener en cuenta la posibilidad de conversión de la cirugía, tanto a laparoscopia convencional como a cirugía abierta, lo que hace necesario disponer del instrumental adecuado en caso necesario.
FUNCION DOCENTE
El personal de enfermería del equipo de Cirugía Robótica del HCSC viene realizando desde el inicio del Plan una importante función docente y de difusión hacia otros profesionales, puesto que se trata de una técnica innovadora que se encuentra en los inicios de su aplicación en un hospital universitario.
Es básico para la realización de la intervención en cirugía robótica que la enfermería tenga experiencia previa en cirugía laparoscópica y sobre todo aptitud e interés.
En nuestro Hospital se han desarrollado una serie de talleres de demostración (Fig.7) para el conocimiento y manejo de los tres componentes del sistema Da Vinci.Hemos trasmitido nuestra experiencia y conocimientos a distintos facultativos y además somos los encargados de instruir a enfermeros y auxiliares en la manipulación, limpieza y esterilización del instrumental y el funcionamiento ymantenimiento del sistema, así como del correcto manejo del carro quirúrgico (robot) por parte del personal no sanitario (celadores).
Figura 7. Sala de demostración
LABOR DE DIFUSIÓN
El personal de enfermería que forma parte del equipo de Cirugía Robótica del HCSC ha colaborado junto con el resto del equipo en la difusión de la cirugía robótica a través de la prensa escrita, medios de televisión con reportajes, y a través de conferencias en diversos Congresos a nivel tanto nacional como internacional. En el mes de abril de 2007 participamos en una Mesa Redonda sobre Cirugía Robótica en el VI Congreso Nacional de la Sociedad Española de Cirugía Laparoscópica (Fig.8) y en el mes de mayo del mismo año, en otra Mesa Redonda en las Jornadas Internacionales de Cirugía Robótica que se celebraron en nuestro Hospital (Fig.9).



















No hay comentarios:
Publicar un comentario